М.Р. Бисенгалиева, Н.С. Бектурганов, Д.Б. Гоголь, Ш.Т. Таймасова
История статьи:
Получена 8 декабря 2015 года
Получена в пересмотренном варианте 27 февраля 2017 года
Принята 23 марта 2017 года
Доступна онлайн с 25 марта 2017 года
Ключевые слова:
Халькантит; сульфат меди; адиабатическая калориметрия; теплоемкость; термодинамические функции; природные минералы
Аннотация
Теплоемкость природного халькантита (пентагидрата сульфата меди, CuSO4 5H2O) из месторождения Космурун была измерена методом низкотемпературной адиабатической калориметрии в температурном интервале (4.3-320) К. Идентификация минерала была доказана методами рентгеноструктурного анализа, микрорентгеноспектрального анализа, ИК- и рамановской спектроскопии. Термодинамические функции были рассчитаны на основе экспериментальных данных по теплоемкости. Был извлечен решеточный компонент теплоемкости менее 20 К. Стандартные значения теплоемкости и энтропии для природного халькантита заключаются в следующем:
CLp, m = 288,0 ± 0,4 Дж моль 1 K 1, SLm = 295,2 ± 0,8 Дж моль 1 K 1.
2017 Эльсевьер Лтд.
1. Введение
В зонах окисления медных отложений, особенно в засушливом климате, широко распространен природный минеральный халькантит (медносульфатный пентагидрат CuSO4 5H2O). Он образуется как один из основных конечных продуктов метаморфизма медных минералов. Благодаря своей высокой растворимости он является источником ионов меди в геохимической миграции элементов. Халькантит встречается в сплошных или сталактитовых формах с радиальной волокнистой структурой. Его цвет варьируется от небесно-голубого до темно-синего; кристаллы редки и, как правило, они малы. Железо, иногда цинк, кобальт и магний встречаются среди основных примесей в минерале.
В Казахстане халькантит встречается на медно-цинковом месторождении Космурун, расположенном в Аягузском районе Восточно-Казахстанской области, в 350 км от города Усть-Каменогорск. Зона окисления в магматических породах в осадке представлена небольшим выбросом из коры выветривания (толщиной 10-30 м). На участках развития сульфидной минерализации толщина коры выветривания составляет 40-50 м. Здесь также встречается ряд других сверхгенных минералов меди, цинка, свинца и железа.
Халькантит часто образуется в качестве вторичного минерала на заброшенных рудниках и истощенных карьерах. Вместе с грунтовыми водами этот вторичный минерал можно перемещать на значительные расстояния, и он служит основой для образования меди в других природных соединениях. Таким образом, надежные данные по термодинамических свойствах природного халькантита необходимы для ряда расчетов геохимических и минералогических взаимодействий с участием данного минерала, а также для различных технологических процессов.
В известном справочнике Р. Роби и Б. Хемингуэя [1] приведены термодинамические свойства халькантита со ссылкой на работы [2,3], которые, в свою очередь, возвращаются к исследованию [4], основанному на измерениях, выполненных несколько десятилетий назад. Кроме того, существует ряд известных физических и физико-химических исследований [5-17], которые в основном связаны с синтетическими образцами. Наиболее подробные результаты калориметрических и магнитных измерений синтетического пентагидрата сульфата меди при температуре жидкого гелия и ниже приведены в [18-22].
Природный медносульфатный пентагидрат халькантита CuSO4 5H2O кристаллизуется в триклинной системе с пространственной группой P1, т. е. имеет низкую степень симметрии, характеризующуюся только центром инверсии. В [23,24] определены параметры элементарной ячейки халькантита: длина краев a = 6,141 Å, b = 10,736 Å, c = 5,986 Å, степени углов a = 82,27L, b = 107,43L, c = 102,67L, а также определены атомарные положения всех атомов в структуре. В более раннем исследовании [25] параметры элементарной ячейки были определены с меньшей точностью, а атомные положения атомов водорода не определялись. Существует также ряд работ по синтетическому халькантиту с его кристаллической структурой и структурными свойствами [26-29]. Результаты кристаллографических исследований показывают, что наличие пространственной системы медных цепей характерно для кристаллической структуры халькантита. Медные цепи доступны и в других минералах меди [30,31], для которых характерно упорядочение магнитных моментов при низких температурах [32-37].
2. Экспериментальный раздел
2.1. Описание образца
Для проведения экспериментальных измерений теплоемкости природного образца медносульфатного пентагидрата CuSO4 5H2O (месторождение Космурун, горный хребет Чингис в Центральном Казахстане) была выбрана мономинеральная фракция. Отбор проб мономинеральной фракции включал предварительную диссипацию, концентрирование и селекцию под бинокулярным микроскопом MBS-10 и Carl Zeiss Stemi-2000C с переменным увеличением (до 50) кристаллов образца, не содержащих видимых примесей. Отобранные кристаллы халькантита имеют стекловидный блеск и синий цвет. Они в основном представляют собой фрагменты неправильной формы с размером кристалла в среднем менее 1 мм (Рис.1). Всего было отобрано около 2,3 г испытуемого образца для физико-химического анализа и прямых измерений теплоемкости минерала
Исследование рентгенографическое фазовое исследование халькантита проводилось на рентгеновском дифрактометре ДРОН-2 с Fe-анодом. Текущие параметры: Utub = 35 кВ; Ia = 10 мА; параметры прорези: 1,0-1,0-0,25 мм; скорость вращения счетчика 0,25 л/мин. В качестве образца мы использовали рефлекс (302) кварца (стандартный образец фазового состава SOFC 5/84, разработанный Всероссийским институтом минерального сырья (ВИМС). Удельная доля мономинеральной фракции образца для рентгеновских измерений составляла около 0,2 г. Идентификация минерала проводилась в соответствии с положением максимумов 54 по рентгенограмме (Рис.2) в диапазоне углов h от 50L до 3L (1,3-8 Å), соответствующих данным о положениях отражения максимумы халькантита, данные в кристаллографических базах данных ASTM (карта 11-646) и MINCRYST [38]. Большинство экспериментальных пиков соответствует между линиями, представленными в базе данных, что указывает на то, что исследуемый образец идентичен минералу халькантита CuSO4 5H2O.
Спектроскопические исследования мономинеральной фракции халькантита проводились на инфракрасном Фурье-спектрометре FSM-1201 (Институт органического синтеза и углехимии, г. Караганда, Казахстан) в диапазоне 450-5000 см 1 и комбинационном спектрометре SPEX TripleMate (Институт неорганической химии им. Николаева СО РАН, г. Новосибирск) в диапазоне 100-1200 см 1. Полученные спектры показаны на Рис. 3 и 4.
В экспериментальных ИК-спектрах и Рамановских спектрах халькантита мы выделили отдельные полосы поглощения с использованием программы PeakFit 4.12 [39]. Полученные линии в спектрах ИК и Рамана природного халькантита хорошо согласуются с известными экспериментальными данными [29, 40-49]. На Рис.3 видно, что полосы поглощения в ИК-спектре халькантита в диапазоне 2000-4500 см 1 имеют сложную структуру из-за большого количества молекул воды в структуре минерала в симметрично неэквивалентных положениях

Рис. 1. Кристаллы халькантита с месторождения Космурун: слева - увеличение 50, справа - увеличение 200.
Для определения кристаллохимической формулы мы провели физико-химический анализ основных компонентов и микроэлементов в мономинеральной фракции халькантита с использованием электронно-лучевого микроанализатора JCXA-733 JEOL с системой электронно-зондирующего энергодисперсионного микроанализа INCA Energy SEM 300, Oxford Instrument (Институт геологических наук им. К.И. Сатпаева, г. Алматы, Казахстан). Разрешение 133 эВ при 5.9 кэВ (Mn-катод), разрешение во вторичных электронах (режим SEI) 7 нм, увеличение от 40 до 360 000, зонд-ток 10 12-10 5 А, ускоряющее напряжение 1-50 кВ, элементы проанализированы: от бора до урана. Более подробное описание исследования состава и структуры изученных образцов было представлено в предыдущей работе [50].
Содержание основного элемента и микроэлементов в образце определяли с помощью электронного микрозондового анализа (Табл. 1). Как следует из результатов анализа, при преобразовании компонентов в мольные отношения основными примесями являются атомы железа и фосфора, изоморфно входящие в состав катионной и анионной групп соответственно.
Мы полагаем, что кремний содержится в образце в основном как механическая примесь в виде пыли и микродисперсных частиц песка на поверхности кристаллов. Чрезвычайно сложно избавиться от этих примесей путем вымывания, поскольку сам халькантит растворяется в воде, но при использовании других растворителей возможно, что молекулы воды могут перейти от кристаллической структуры образца к раствору. Изоморфное замещение сульфат-ионов для ионов силиката в минералах весьма нехарактерно, поскольку в соответствии с Правилами Гольдшмидта ионные радиусы S(+6) и Si(+4) сильно различаются, а разница между электроотрицательностью этих элементов больше 0,4. Поэтому кремний не включался в кристаллическую химическую формулу соединения.
Поскольку результаты термогравиметрического анализа показывают, что содержание воды в образце составляет не менее пяти молекул на молекулярную единицу, мы считаем, что содержание воды в образце равно теоретическому. Гидраты кристаллов меди, имеющие большее содержание воды, нестабильны в нормальных атмосферных условиях, и нет оснований полагать, что часть их представлена ими. Избыток мольной доли воды в образце по теоретическому значению составляет 1,009, что можно рассматривать как находящееся в пределах неточности измерений.
Основываясь на результатах анализа основных и примесных компонентов минерала, мы нашли кристаллохимическую формулу тестового образца халькантита: Cu0,98Fe0,02 {[SO4]0,99[PO4]0,01}5H2O. Разница между относительными молекулярными массами минерала, рассчитанная как теоретическими, так и найденными кристаллохимическими формулами, составляет 0,066%.
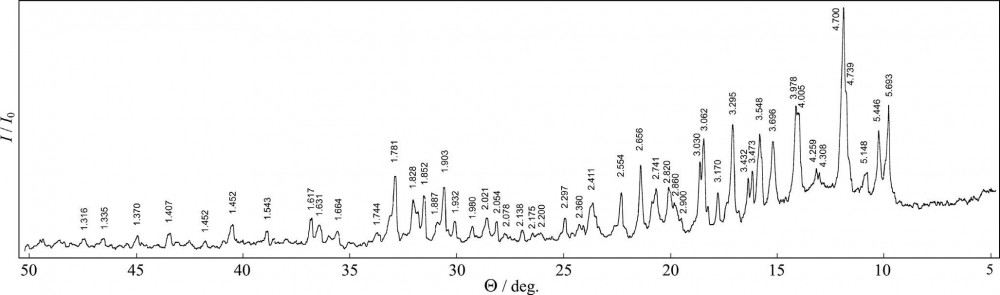
Рисунок 2. Рисунок рентгеновской дифракции естественного образца халькантита; числа в верхних точках показывают межплоскостное расстояние d (Å).
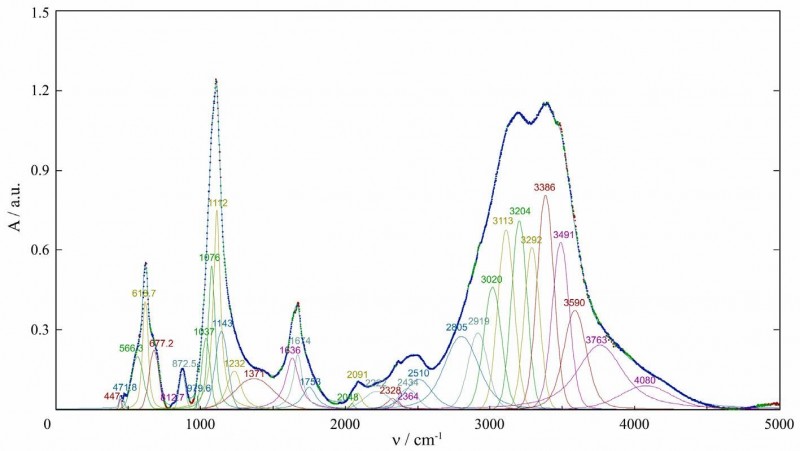
Рисунок 3. Инфракрасный спектр природного халькантита.
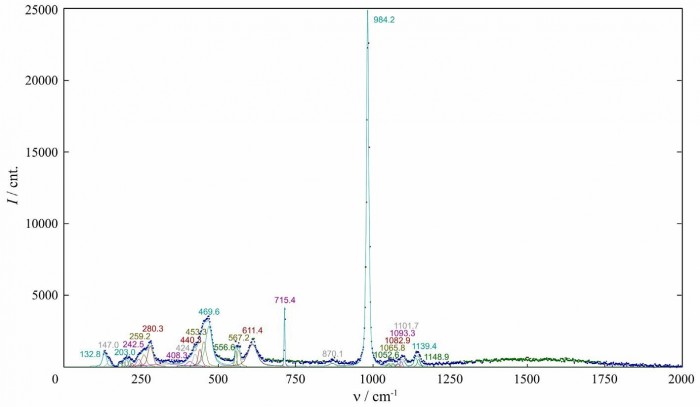
Рисунок 4. Рамановский спектр природного халькантита..
Таблица 1
Химический состав образца природного халькантита и синтетического медносульфатного пентагидрата.
| Состав
|
Химическая формула
|
Массовая доля
|
Мольная концентрация
|
Метод анализа
|
|
| Среднее значение
|
ua
|
||||
| Природный халькантит (месторождение Космурун, Центральный Казахстан)
|
|||||
| Оксид меди (II)
|
CuO
|
0.3100
|
0.00585
|
0.137
|
EMPAb
|
| Оксид железа (II)
|
FeO
|
0.0043
|
0.00053
|
0.002
|
EMPA
|
| Оксид цинка (II)
|
ZnO
|
0.0005
|
0.00013
|
<3·10-4
|
EMPA
|
| Оксид кальция (II)
|
CaO
|
0.0003
|
0.00005
|
<2·10-4
|
EMPA
|
| Оксид магния (II)
|
MgO
|
0.0001
|
0.00007
|
<2·10-4
|
EMPA
|
| Оксид свинца (II)
|
PbO
|
0.0004
|
0.00012
|
<1·10-4
|
EMPA
|
| Оксид серы (VI)
|
SO3
|
0.3118
|
0.00737
|
0.137
|
EMPA
|
| Оксид фосфора (V)
|
P2O5
|
0.0015
|
0.00016
|
0.001
|
EMPA
|
| Оксид кремния (IV)
|
SiO2
|
0.0016
|
0.00013
|
0.001
|
EMPA
|
| Оксид алюминия (III)
|
Al2O3
|
0.0001
|
0.00005
|
<1·10-4
|
EMPA
|
| Хлор
|
Cl
|
0.0005
|
0.00004
|
<3·10-4
|
EMPA
|
| Вода
|
H2O
|
0.369
|
0.0045c
|
0.721
|
TGd
|
| Синтетический медносульфатный пентагидрат (АО «Уралэлектромедь»)
|
|||||
| Медный купорос
|
CuSO4·5H2O
|
0.995
|
н/п
|
|
TAe,f
|
| Медь
|
Cu
|
0.2532
|
н/п
|
|
TAf
|
| Железо
|
Fe
|
0.00012
|
н/п
|
|
PAf,g
|
| Серная кислота
|
H2SO4
|
0.0005
|
н/п
|
|
TAf
|
| Мышьяк
|
As
|
0.000035
|
н/п
|
|
PAf
|
| Нерастворимый остаток
|
н/п
|
<0.0002
|
н/п
|
|
GAf,h
|
| Влажность
|
H2O
|
0.003
|
н/п
|
|
GA
|
- Стандартные неточности u рассчитываются на основе 5 микрозондовых параметров.
- Электронный микрозондовый анализ.
- Неточность является инструментальной ошибкой.
- Термогравиметрия.
- Титриметрический анализ.
- В соответствии с ГОСТ 19347–99.
- Фотометрический анализ.
- Гравиметрический анализ.
2.2. Измерения теплоемкости синтетического образца
Перед проведением низкотемпературных измерений теплоемкости природного образца халькантита мы провели измерения синтетического образца для определения особенностей поведения молекул воды в структуре минералов с изменением температуры, а также для осуществления процедуры размещения образца в контейнере. Синтетический образец получали двойной перекристаллизацией пентагидрата сульфата меди класса А1 из АО «Уралэлектромедь» (Таблица 1).
Содержание остаточной свободной воды в синтетическом образце определяли гравиметрически. Взвешенная часть образца, взятая до пятого знака после запятой, подвергалась сушке в эксикаторе в течение нескольких недель. В предыдущей работе [50] было обнаружено, что потеря первой молекулы кристаллизационной воды начинается уже при 40-50 °С. Кроме того, давление водяного пара над кристаллом кристаллического гидрата CuSO4 5H2O, при котором начинается первое расщепление молекулы воды, составляет 4,85 мм рт.ст. при 20 °С. Таким образом, для данной цели непригодны широко распространенные десорбирующие вещества, такие как оксид кальция CaO и хлорид кальция CaCl2, поскольку они могут отбирать кристаллизационную воду до третьей стадии. Поэтому для сушки синтетического пентагидрата сульфата меди мы использовали раствор серной кислоты с концентрацией 50 мас.%; давление водяного пара над раствором составляет 5,95 мм рт.ст. при 20 °С. Одновременно выполнялись некоторые контрольные эксперименты. В ходе этих экспериментов взвешенные части синтетического образца медносульфатного пентагидрата содержались на открытом воздухе при комнатной температуре (20 °С) и при температуре 30 °С. Во всех взвешенных частях образцов потеря веса составляла около 0,27-0,32%, а для образцов, хранящихся на открытом воздухе, наблюдалось увеличение разброса значений в зависимости от изменений влажности воздуха.
Измерения теплоемкости синтетического образца проводились на низкотемпературной теплофизической установке производства компании «Термакс» [51]. Вес образца составил 0,7732 г, когда измерения проводились в азотной и гелиевой областях. Значение молярной массы синтетического образца, рассчитанное для идеальной формулы соединения, составило 249,685 г/моль.
Чтобы избежать потери кристаллизационной воды образцов в процессе вакуумирования контейнера, когда он заполнялся теплоносителем гелия, газ поднимали через дистиллированную воду при пониженном давлении, при котором парциальное давление воды в гелии было равное давлению потери первой молекулы кристаллизационной воды в пентагидрате сульфата меди. Контейнер, заполненный увлажненным гелием, герметизирован с помощью прокладок из фольги из индия. Рабочую часть установки с установленным контейнером с образцом охлаждали в течение дня в жидком азоте до температуры 77,8 К, затем калориметр помещали в колбу Дьюара, содержащую жидкий гелий для дальнейшего охлаждения в течение 12-14 ч для достижения самой низкой температуры 4,22 К.
Мы получили 4 серии измерений теплоемкости в азотной области температур и 2 серии измерений в гелиевой области температур. Результаты представлены в Приложении А. Экспериментальная зависимость теплоемкости синтетического образца показана на рисунке в Приложении А. В синтетическом образце халькантита имеется сильная верхняя точка с максимумом при 271 К, что соответствует кристаллизации свободной воды. Имеются также небольшие дополнительные верхние точки при 254 и 277 К, связанные с фазовыми переходами молекул воды различной степени комбинированного состояния. Следовательно, в дополнение к кристаллическим молекулам вода в структуре синтетического образца присутствует в адсорбированной и свободной форме в виде включений между кристаллами в агрегатах. Изученный образец не подвергался какому-либо существенному воздействию конденсации воды. При микроскопическом исследовании образца после измерений теплоемкости мы не обнаружили никаких следов растворения или выветривания на гранях кристаллов (Рис.5).
Рисунок 5. Кристаллы синтетического пентагидрата сульфата меди при увеличении x50: слева - перед измерением теплоемкости; справа - после измерения теплоемкости
Значение изменения энтальпии для верхней точки при 271 К (верхняя точка соответствует кристаллизационной воде) на кривой молярной теплоемкости синтетического образца медносульфатного пентагидрата было оценено графически и составило 17,8 Дж/моль. Это значение относительно значения молярного тепла плавления льда составляет 0,297%, что хорошо согласуется с данными по влажности синтетического образца.
Измерения теплоемкости природного халькантита проводились по той же методике, что и для синтетического образца. Взвешенная часть природного халькантита составляла 1,05588 г; в соответствии с кристаллико-химической формулой значение молярной массы принималось равным 249,5201 г/моль.
Мы получили 7 серий измерений в гелиевой области температур и 5 рядов в азотной области температур, всего 715 экспериментальных точек. Шаг измерений составлял 0,3 К при 4-6 К, 0,5 К при 6-10 К, 1 К при 10-20 К, 2 К при 20-70 К и 3 К выше 70 К. В области азота мы также переносили из серии измерений с уменьшенным шагом 1 К и 2 К. Периоды нагрева калориметра и измерение температуры работы установки составляли 600 с. Экспериментальные значения теплоемкости образца показаны на Рис.6 и в Приложении Б. На экспериментальной кривой температурной зависимости теплоемкости природного халькантита нет видимых признаков фазового перехода, связанного с кристаллизационной водой, которые были обнаружены в синтетическом образце. Отсутствие несвязанной воды указывает на более высокое структурное совершенство естественного образца по сравнению с синтетическим. Включения в синтетический образец в первую очередь обусловлены наличием межкристаллитной воды.
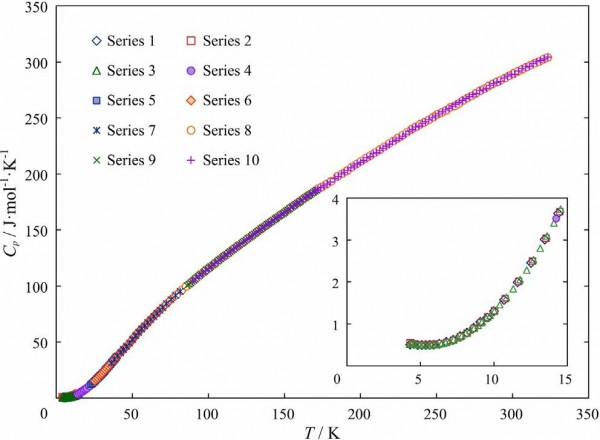
Рисунок 6. Температурная зависимость теплоемкости халькантита.
3. Результаты и обсуждение
Комплекс экспериментальных значений теплоемкости был разделен на интервалы, в которых экспериментальные данные были сглажены методом аппроксимации сплайна полиномами 3-й степени типа Cp = a0 + a1T + a2T2 + a3T3 [52,53]. Перекрытие экспериментальных данных в областях изменения полиномов составляло не менее 3-4 пунктов. Используя полученные уравнения, мы рассчитали отклонение экспериментальных точек от сглаженных значений и определили границы коридора, который включает 95% экспериментальных пунктов. Ошибки расчета интегральных термодинамических функций определялись на основе уравнений, описывающих границы коридора. Разброс экспериментальных пунктов относительно сглаженной кривой и коэффициентов найденных полиномов, использованных для вычисления термодинамических функций природного халькантита, приведены в Приложении C.
Температурные зависимости термодинамических функций S(T), H(T) H(0) и U(T) образца определялись коэффициентами полученных полиномов в соответствии с известными уравнениями. Найденные значения термодинамических функций природного халькантита (теплоемкость, энтропия, изменение энтальпии, сниженный термодинамический потенциал) приведены в Таблице 2.
При температурах ниже 10 К в теплоемкости халькантита наблюдалось заметное отклонение от нормального хода кривой, связанного с завершением фазового перехода, максимум которого лежит ниже 4 К. Чтобы выделить аномальную составляющую, мы использовали метод, который применялся для выделения магнитного компонента в теплоемкости других природных сульфидов меди - антлерита и брошантита [37].
Решетчатая составляющая теплоемкости была рассчитана в соответствии с уравнениями, приведенными в [54,55]:

где T - температура (K), CL - теплоемкость решетки (Дж моль 1-K 1), n - число атомов в молекуле, K - постоянная, связанная с дебаевской характеристической температурой (Дж моль 1 K 4), R - универсальная газовая постоянная, m - эмпирический коэффициент.
На Рисунке 7 показана теплоемкость халькантита в координатах ln (Cp/T3) относительно ln (1 Cp/3Rn). В Приложении D приведены расчетные значения теплоемкости решетки и значения аномальной консистенции, полученные как разность между экспериментальной теплоемкостью и теплоемкостью решетки. Полученное завершение фазового перехода в халькантите при температуре от 4 до 13 К несколько отличается от ранее выявленных магнитных отклонений в антлеритах и брошантите и имеет ярко выраженный экспоненциальный характер (Рис.8). Аномалия подобного рода имеет ряд общих особенностей с аномалией Шоттки, неоднократно описанной для разных соединений [56-58].
Таблица 2
Термодинамические функции (молярная теплоемкость CpL, молярная энтропия SL, изменение молярной энтальпии DHL, уменьшенный изобарно-изотермический потенциал U, при температуре T) природного халькантита Cu0,98Fe0,02{[SO4]0,99[PO4]0,01}5H2O с обширными неточностями (уровень достоверности 0,95) при среднем атмосферном давлении pa = 0,09539 МПа.a
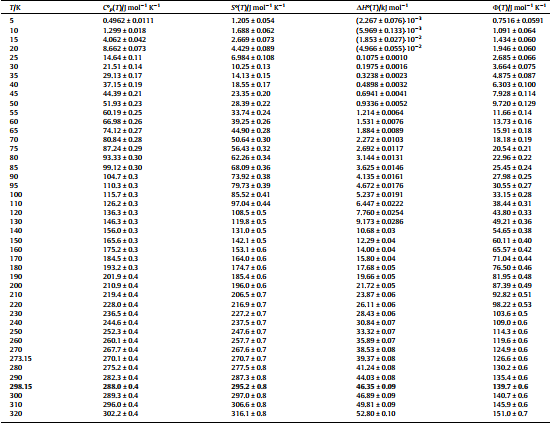
a Стандартная неточность атмосферного давления u (pa) = ± 0,00075 МПа.
Рисунок 8. Аномальная теплоемкость в халькантите: кружки – экспериментальные значения;
пунктирная линия – экстраполированные значения по
уравнению Шоттки
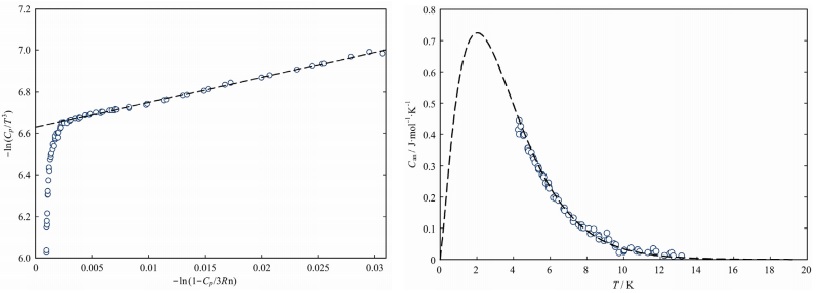
Рисунок 7. Теплоемкость халькантита
при температурах от 4 до 25 К
в координатах ln(Cp/T3) относительно ln(1 Cp/3Rn):
пунктирная линия – теплоемкость кристаллической решетки
Чтобы дать правильное описание теплоемкости в области отклонений и экстраполяции значений до абсолютного нуля, значения были рассчитаны в соответствии с уравнением вида Can = aTbecT. Значения коэффициентов (a = 1.0649, b = 1.3066, c = 0.64529) были найдены путем преобразования уравнения в логарифмическую форму и сглаживания полученных значений аномальной теплоемкости. Эта экстраполяция является эмпирическим приближением, позволяющим оценить дополнительный вклад в термодинамические функции соединения и не отражает реального хода теплоемкости, поскольку в [18,22] авторы указали на наличие нескольких максимумов ниже 4 K. Рассчитанный максимум аномальной теплоемкости падает на температуру около 2 К; значение аномальной энтропии составляет 5,0 Дж/моль К.
В низкотемпературной теплоемкости медносульфатного пентагидрата наблюдаются несколько отклонений, связанных с постепенным упорядочением магнитных моментов медных цепей в кристаллической структуре соединения [18,22]. Максимальная верхняя точка составляет 0,034 К, еще одна заметная верхняя точка находится примерно на 1,37 К. Каждый из этих магнитных переходов соответствует упорядочению магнитных моментов атомов меди, расположенных в определенном кристаллографическом положении, и вносит соответствующий вклад в теплоемкости и полной энтропии системы. В первой аппроксимации сумма данных вкладов может быть описана с помощью уравнения Шоттки для двух состояний.
В [18-22] авторы ранее описали измерение теплоемкости и магнитных свойств синтетического образца пентагидрата сульфата меди при температурах от 0,2 до 4 К. Для объяснения обнаруженного отклонения аномалии было сделано предположение о магнитном упорядочении в цепочках меди в кристаллической структуре соединения. Значение энтропии, полученное авторами, составляло R ln 2. Наше значение близко к этому значению с учетом ошибки экстраполяции. Таким образом, наши результаты являются дополнительным подтверждением данных, полученных этими авторами [18-22].
4. Заключение
В результате калориметрических измерений природного образца халькантита получены значения основных термодинамических функций минерала в температурном интервале 5-320 К. Было обнаружено различие между синтетическим сульфатом меди и природным минералом. Оно заключается в присутствии следов воды, внося свой вклад в теплоемкость синтетического образца. Было подтверждено наличие отклонения при температурах ниже 10 К; и была проведена оценка аномальной энтропии соединения.
Выражение признательности
При проведении исследования была оказана поддержка со стороны Комитета науки Министерства образования и науки Республики Казахстан в рамках научного гранта № 0615/GF2 «Исследование фундаментальных термодинамических и термохимических параметров кислородсодержащих природных соединений цветных металлов».
Приложение A. Дополнительная информация
Дополнительная информация, относящаяся к данной статье, доступна онлайн по ссылке http://dx.doi.org/10.1016/j.jct.2017.03.026.
Ссылки
- R. Robie, B. Hemingway, Thermodynamic properties of minerals and related substances at 298.15 K and 1 bar (105 Pascals) pressure and at higher temperatures, U.S. Gov. Printing Office, Washington, 1995.
- C.W. DeKock, Thermodynamic properties of selected transition metal sulphates and their hydrates, Information Circular 8910, U.S. Bur. Mines, 1982.
- D.D. Wagman, W.H. Evans, V.B. Parker, R.H. Schumm, I. Halow, S.M. Bailey, K.L. Churney, R.L. Nuttall, The NBS tables of chemical thermodynamic properties. Selected values for inorganic and C1 and C2 organic substances in SI units, J. Phys. Chem. Ref. Data 11 (2) (1982) 1–392.
- D.D. Wagman, W.H. Evans, V.B. Parker, I. Halow, S.M. Bailey, R.H. Schumm, Selected values of chemical thermodynamic properties. Tables for elements 35 through 53 in the standard order of arrangement, Technical Note 270–4, U.S. Nat. Bur. Stand., 1969.
- R.J. Benzie, A.H. Cooke, The magnetic susceptibility of copper sulphate, Proc. Phys. Soc. A 64 (1951) 124–128, http://dx.doi.org/10.1088/0370-1298/64/2/ 303.
- R. Kiriyama, H. Ibamoto, Dielectric dispersion of copper sulphate pentahydrate crystals, Bull. Chem. Soc. Jpn. 25 (1952) 359–360, http://dx.doi.org/10.1246/ bcsj.25.359.
- G.A. Candela, Influence of paramagnetic resonance on the static susceptibility. Spin-lattice relaxation time of cupric sulfate pentahydrate, J. Chem. Phys. 42 (1965) 113–117, http://dx.doi.org/10.1063/1.1695655.
- A.J. de Vries, D.A. Curtis, J.W.M. Livius, A.J. van Duyneveldt, C.J. Gorter, Spin-lattice relaxation in a few hydrated paramagnetic sulphates, Physics 36 (1967) 91–106, http://dx.doi.org/10.1016/0031-8914(67)90082-1.
- J.W. Larson, P. Cerutti, H.K. Garber, L.G. Hepler, Electrode potentials and thermodynamic data for aqueous ions. Copper, zinc, cadmium, iron, cobalt, and nickel, J. Phys. Chem. 72 (1968) 2902–2907, http://dx.doi.org/10.1021/j100854a037.
- A. Phillipson, G.R. Finlay, Heats of formation of some hydrates, Can. J. Chem. 54 (1976) 3163–3168, http://dx.doi.org/10.1139/v76-450.
- H. Tagawa, H. Saijo, Kinetics of the thermal decomposition of some transition metal sulfates, Thermochim. Acta 91 (1985) 67–77, http://dx.doi.org/10.1016/ 0040-6031(85)85202-3.
- I.-M. Chou, R.R. Seal II, B.S. Hemingway, Determination of melanterite-rozenite and chalcanthite-bonattite equilibria by humidity measurements at 0.1 MPa, Am. Mineral. 87 (2002) 108–114, http://dx.doi.org/10.2138/am-2002-0112.
- M. Olszak-Humienik, J. Mozejko, Eyring parameters of dehydration processes, Thermochim. Acta 405 (2003) 171–181, http://dx.doi.org/10.1016/S0040-6031(03)00125-4.
- B. Cage, S. Russek, Design for a multifrequency high magnetic field superconducting quantum interference device-detected quantitative electron paramagnetic resonance probe: Spin-lattice relaxation of cupric sulfate pentahydrate, Rev. Sci. Instrum. 75 (2004) 4401–4405, http://dx.doi.org/ 10.1063/1.1808893.
- C. Christov, Thermodynamics of formation of double salts and mixed crystals from aqueous solutions, J. Chem. Thermodyn. 37 (2005) 1036–1060, http://dx. doi.org/10.1016/j.jct.2005.01.008.
- K.-D. Grevel, J. Majzlan, Internally consistent thermodynamic data for metal divalent sulphate hydrates, Chem. Geol. 286 (2011) 301–306, http://dx.doi. org/10.1016/j.chemgeo.2011.05.016.
- I.-M. Chou, R.R. Seal II, A. Wang, The stability of sulfate and hydrated sulfate minerals near ambient conditions and their significance in environmental and planetary sciences, J. Asian Earth Sci. 62 (2013) 734–758, http://dx.doi.org/ 10.1016/j.jseaes.2012.11.027.
- T.H. Geballe, W.F. Giauque, The heat capacity and magnetic properties of single crystal copper sulfate pentahydrate from 0.25 to 4LK, J. Am. Chem. Soc. 74 (1952) 3513–3519, http://dx.doi.org/10.1021/ja01134a017.
- R.J. Anderson, W.F. Giauque, Heat capacity, entropy, and magnetic moment of single-crystal CuSO4 5H2O with fields to 90 kG || to the a magnetic axis, J. Chem. Phys. 46 (1967) 2413–2428, http://dx.doi.org/ 10.1063/1.1841050.
- W.F. Giauque, R.A. Fisher, E.W. Hornung, G.E. Brodale, Magnetothermodynamics of single-crystal CuSO4 5H2O. II. Fields || to the a-magnetic axis. Thermodynamic temperature and heat capacity without heat introduction below 0.4LK. Calorimetric heat capacity from 0.4L-4.2LK with fields of 1 and 3 kG, J. Chem. Phys. 48 (1968) 3728–3734, http://dx.doi.org/ 10.1063/1.1669678.
- W.F. Giauque, G.E. Brodale, R.A. Fisher, E.W. Hornung, Magnetothermodynamics of single-crystal CuSO4 5H2O. IV. Properties over the range 0.4L-4.2LK with fields to 90 kG || to the b magnetic axis, J. Chem. Phys. 49 (1968) 1848–1859, http://dx.doi.org/10.1063/1.1670317.
- W.F. Giauque, R.A. Fisher, E.W. Hornung, G.E. Brodale, Magnetothermodynamics of single crystal CuSO4 5H2O. V. Fields along the b axis. Thermodynamic temperature without heat introduction below 0.5LK. A reference at 0.035LK, J. Chem. Phys. 53 (1970) 3733–3744, http://dx.doi.org/ 10.1063/1.1674557.
- G.E. Bacon, N.A. Curry, The water molecules in CuSO4 5H2O, Proc. Royal Soc. A 266 (1962) 95–108, http://dx.doi.org/10.1098/rspa.1962.0049.
- G.E. Bacon, D.H. Titterton, Neutron-diffraction studies of CuSO4 5H2O and CuSO4 5D2O, Z. Kristallogr. B 141 (1975) 330–341, http://dx.doi.org/10.1524/ zkri.1975.141.5-6.330.
- C.A. Beevers, H. Lipson, The crystal structure of copper sulphate pentahydrate, CuSO4 5H2O, Proc. Royal Soc. A 146 (1934) 570–582, http://dx.doi.org/ 10.1098/rspa.1934.0173.
- L.D. Iskhakova, V.K. Trunov, T.M. Shchegoleva, V.V. Ilyukhin, A.A. Vedernikov, Crystal structure of chalcanthite CuSO4 5H2O grown under microgravity, Sov. Phys. Crystallogr. 28 (1983) 383–387.
- L. Mestres, M.L. Martinez, A. Rodriguez, X. Solans, The isomorphism between CuSeO4 5H2O and CuSO4 5H2O, Z. Kristallogr. B 180 (1987) 179–187, http://dx. doi.org/10.1524/zkri.1987.180.1-4.179.
- F. Lu, H.S. Wang, X. Zhao, Y. Ozaki, Nucleation and growth of CuSO4 5H2O crystals on the liquid state stearic acid Langmuir-Blodgett film, J. Cryst.Growth 310 (2008) 4652–4655, http://dx.doi.org/10.1016/j. jcrysgro.2008.08.054.
- V.L. Manomenova, M.N. Stepnova, V.V. Grebenev, E.B. Rudneva, A.E. Voloshin, Growth of CuSO4 5H2O single crystals and study of some of their properties, Crystallogr. Rep. 58 (2013) 513–516, http://dx.doi.org/10.1134/ S1063774513030152.
- F.C. Hawthorne, L.A. Groat, R.K. Eby, Antlerite, Cu3SO4(OH)4, a heteropolyhedral wallpaper structure, Can. Mineral. 27 (1989) 205–209.
- S. Merlino, N. Perchiazzi, D. Franco, Brochantite, Cu4SO4(OH)6: OD character, polytypism and crystal structures, Eur. J. Mineral. 15 (2003) 267–275, http:// dx.doi.org/10.1127/0935-1221/2003/0015-0267.
- S. Vilminot, M. Richard-Plouet, G. André, D. Swierczynski, M. Gillot, F. Bourée-Vigneron, M.J. Drillon, Magnetic structure and properties of Cu3(OH)4SO4 made of triple chains of spins s = 1/2, J. Solid State Chem. 170 (2003) 255–264, http://dx.doi.org/10.1016/S0022-4596(02)00081-6.
- S. Vilminot, M. Richard-Plouet, G. André, D. Swierczynski, F. Bourée-Vigneron, M. Kurmoo, Nuclear and magnetic structures and magnetic properties of synthetic brochantite, Cu4(OH)6SO4, Dalton Trans. 11 (2006) 1455–1462, http://dx.doi.org/10.1039/B510545E.
- S. Vilminot, G. André, F. Bourée-Vigneron, M. Richard-Plouet, M. Kurmoo, Magnetic properties and magnetic structures of Cu3(OD)4XO4, X = Se or S: cycloidal versus collinear antiferromagnetic structure, Inorg. Chem. 46 (2007) 10079–10086, http://dx.doi.org/10.1021/ic700900b.
- Y. Fujii, Y. Azuma, H. Kikuchi, Y. Yamamoto, 1H-NMR study of the idle-spin magnet Cu3(OH)4SO4, J. Phys.: Conf. Ser. 145 (2009), http://dx.doi.org/10.1088/ 1742-6596/145/1/012061, 012061/1-012061/4.
- S. Okubo, H. Yamamoto, M. Fujisawa, H. Ohta, T. Nakamura, H. Kikuchi, High field ESR measurements of quantum triple chain system Cu3(OH)4SO4, J. Phys: Conf. Ser. 150 (2009), http://dx.doi.org/10.1088/1742-6596/150/4/042156, 042156/1-042156/4.
- M.R. Bissengaliyeva, D.B. Gogol, Sh.T. Taimassova, N.S. Bekturganov, Heat capacities of natural antlerite and brochantite at the low temperature, J. Chem. Eng. Data 58 (2013) 2904–2912, http://dx.doi.org/10.1021/je400130b.
- http://database.iem.ac.ru/mincryst.
- http://www.sigmaplot.com/products/peakfit/peakfit.php.
- F.A. Miller, G.L. Carlson, F.F. Bentley, W.H. Jones, Infrared spectra of inorganic ions in the cesium bromide region (700–300 cm 1), Spectrochim. Acta 16 (1960) 135–235, http://dx.doi.org/10.1016/0371-1951(60)80077-X.
- S.D. Ross, Forbidden transitions in the infra-red spectra of some terahedral anions – II. Sulphates, Spectrochim. Acta 18 (1962) 1575–1578, http://dx.doi. org/10.1016/0371-1951(62)80021-6.
- A. Hezel, S.D. Ross, Forbidden transitions in the infra-red spectra of tetrahedral anions – III. Spectra-structure correlations in perchlorates, sulphates and phosphates of the formula MXO4, Spectrochim. Acta 22 (1966) 1949–1961, http://dx.doi.org/10.1016/0371-1951(66)80183-2.
- S.V.J. Lakshman, B.J. Reddy, Optical absorption spectra of Cu2+ in chalcanthite and malachite, Can. Mineral. 12 (1973) 207–210.
- J.A. Gadsden, Infrared Spectra of Minerals and Related Inorganic Compounds, Butterworths, London, 1975
- A.I. Boldyrev, Infrared Spectra of Minerals, Nedra, Moscow, 1976 (In Russian).
- M. Bouchard, D.C. Smith, Catalogue of 45 reference Raman spectra of minerals concerning research in art history of archaeology, especially on corroded metals and coloured glass, Spectrochim. Acta 59A (2003) 2247–2266, http:// dx.doi.org/10.1016/S1386-1425(03)00069-6.
- V. Hayez, J. Guillaume, A. Hubin, H. Terryn, Micro-Raman spectroscopy for the study of corrosion products on copper alloys: Setting up of a reference database and studying works of art, J. Raman Spectrosc. 35 (2004) 732–738, http://dx.doi.org/10.1002/jrs.1194.
- P. Makreski, G. Jovanovski, S. Dimitrovska, Minerals from Macedonia. XIV. Identification of some sulfate minerals by vibrational (infrared and Raman) spectroscopy, Vib. Spectrosc. 39 (2005) 229–239, http://dx.doi.org/10.1016/j. vibspec.2005.04.008.
- O. Sracek, F. Veselovsky´, B. Krˇíbek, J. Malec, J. Jehlicˇka, Geochemistry, mineralogy and environmental impact of precipitated efflorescent salts at the Kabwe Cu–Co chemical leaching plant in Zambia, Appl. Geochem. 25 (2010) 1815–1824, http://dx.doi.org/10.1016/j.apgeochem.2010.09.008.
- M. Bissengaliyeva, L. Ogorodova, M. Vigasina, L. Mel’chakova, D. Kosova, I.r. Bryzgalov, D. Ksenofontov, Enthalpy of formation of natural hydrous copper sulfate: Chalcanthite, J. Chem. Thermodyn. 95 (2016) 142–148, http://dx.doi. org/10.1016/j.jct.2015.12.010.
- M.R. Bissengaliyeva, D.B. Gogol, S.T. Taymasova, N.S. Bekturganov, Measurement of heat capacity by adiabatic calorimetry and calculation of thermodynamic functions of standard substances: copper, benzoic acid, and heptane, J. Chem. Eng. Data 56 (2011) 195–204, http://dx.doi.org/ 10.1021/je100658y.
- V.S. Iorish, P.I. Tolmach, The technique and program of low-temperature heat capacity experimental data proceeding with using approximating spline, Zh. Fiz. Khim. 60 (1986) 2583–2587 (In Russian).
- V.A. Titov, L.I. Chernyavskii, I.A. Voronin, A.N. Kornilov, On the spline approximation of low-temperature calorimetry data, Russ. J. Phys. Chem. A 80 (2006) 1025–1028, http://dx.doi.org/10.1134/S0036024406070041.
- G.A. Krestov, K.B. Yatsimirsky, Thermodynamics characteristics of the compositions of cobalt (III) of chlorpentamine type, Zh. Neorg. Khim. 6 (1961) 2294–2303 (In Russian).
- T.P. Melia, R.J. Merrifield, Thermal properties of transition metal compounds: Heat capacity, entropy, enthalpy, free energy and heat of fusion of the tris (acetylacetonato)complexes of scandium(III), vanadium(III), manganese(III), iron(III) and cobalt(III) and the vapour pressure of tris(acetylacetonato) iron (III)–IV, J. Inorg. Nucl. Chem. 32 (1970) 2573–2579, http://dx.doi.org/10.1016/ 0022-1902(70)80304-9.
- K. Ghosh, S. Ramakrishnan, A.D. Chinchure, V.R. Marathe, G. Chandra, Heat capacity studies in RPd2Al3 (R = Ce, Pr, Nd and Sm) systems, Phys. B 223&224 (1996) 354–358, http://dx.doi.org/10.1016/0921-4526(96)00121-4.
- G. Motoyama, M. Watanabe, K. Maeda, Y. Oda, K. Ueda, T. Kohara, Specific heat measurements of CePt3Si and Ce1+xPt3+ySi1+z, J. Magn. Magn. Mater. 310 (2007) e126–e128, http://dx.doi.org/10.1016/j.jmmm.2006.10.517.
- C. He, H. Zheng, J.F. Mitchell, M.L. Foo, R.J. Cava, C. Leighton, Low temperature Schottky anomalies in the specific heat of LaCoO3: Defect-stabilized finite spin states, Appl. Phys. Lett. 94 (2009), http://dx.doi.org/10.1063/1.3098374, 102514/1-102514/3.



